Bài giảng Hóa đại cương - Chương 5: Thế đẳng áp và chiều của các quá trình hóa học
Khái niệm về entropi
S = S2 – S1 = Qtn/T
S = S2 – S1 > Qbtn/T
S ≥ Q/T (Nguyên lý II nhiệt động học)
Entropi là một đại lượng xác định trạng thái hệ, và là hàm trạng thái. Đơn vị của entropi là J/mol độ hay cal/mol độ.
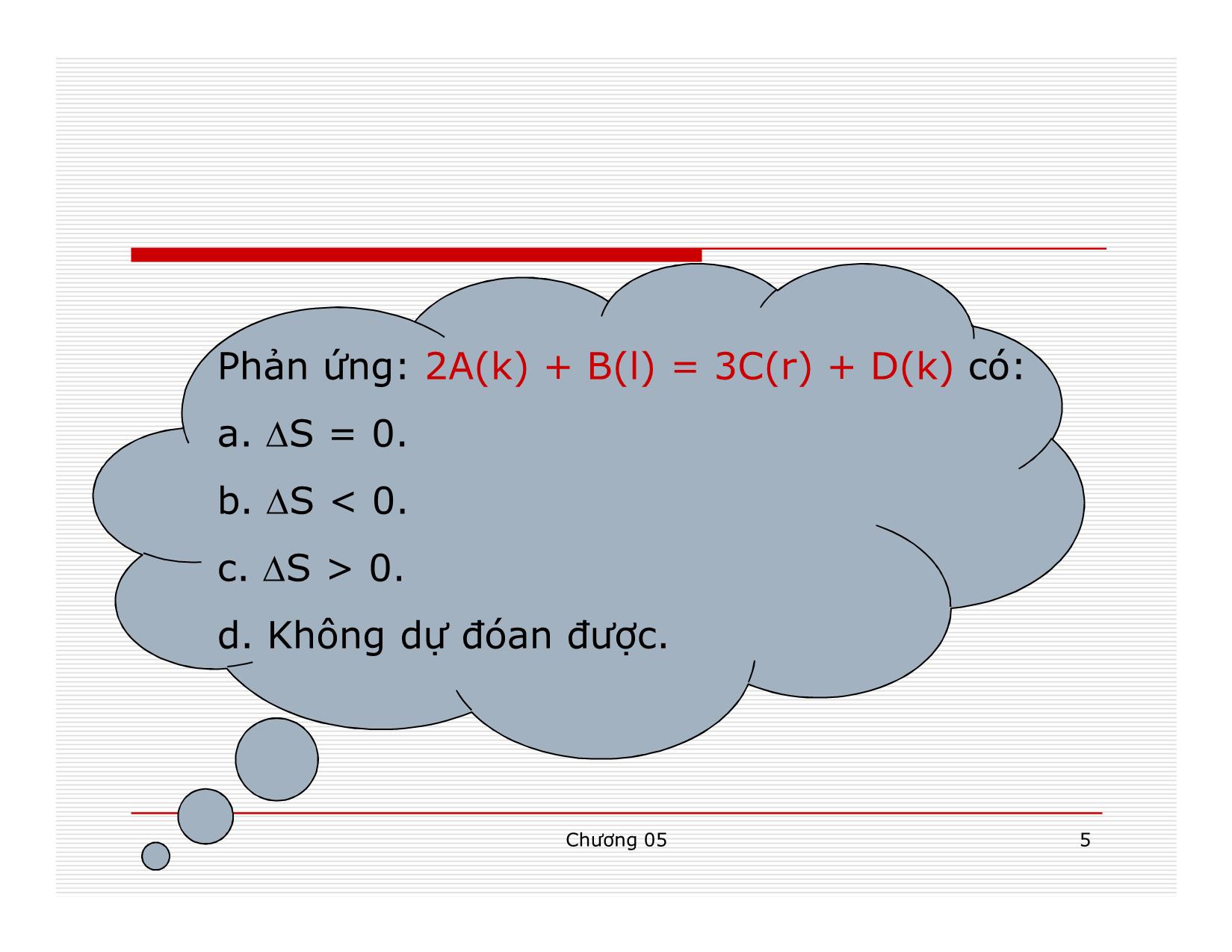
Đối với hệ cô lập: Q = 0 S ≥ 0 Nếu quá trình thuận nghịch, entropi của hệ không đổi; nếu quá trình bất thuận nghịch, entropi của hệ tăng trong hệ cô lập, những quá trình tự xảy ra là những quá trình có kèm theo sự tăng entropi.
Entropy đặc trưng cho mức độ hỗn lọan của hệ.
Bài giảng Hóa đại cương - Chương 5: Thế đẳng áp và chiều của các quá trình hóa học trang 1

Bài giảng Hóa đại cương - Chương 5: Thế đẳng áp và chiều của các quá trình hóa học trang 2

Bài giảng Hóa đại cương - Chương 5: Thế đẳng áp và chiều của các quá trình hóa học trang 3

Bài giảng Hóa đại cương - Chương 5: Thế đẳng áp và chiều của các quá trình hóa học trang 4

Bài giảng Hóa đại cương - Chương 5: Thế đẳng áp và chiều của các quá trình hóa học trang 5
Tải về để xem đầy đủ hơn
File đính kèm:
 bai_giang_hoa_dai_cuong_chuong_5_the_dang_ap_va_chieu_cua_ca.pdf
bai_giang_hoa_dai_cuong_chuong_5_the_dang_ap_va_chieu_cua_ca.pdf



